数据重大漏洞?阿斯利康疫苗在英获批紧急使用但未获欧盟批准
12月30日,欧美第三款新冠疫苗传来了新动态。
阿斯利康官网宣布其COVID-19疫苗获准在英国紧急使用,在18岁及以上的人群中使用。这是该疫苗首次获批使用,同时也是欧美国家第三款被批准紧急使用的新冠疫苗。根据此前公布的三期临床数据,该疫苗在预防性接种两剂14天后有症状的COVID-19发生率为70.4%。
消息一出,阿斯利康股票一度上涨近2%,截至收盘有所回落,涨0.56%。
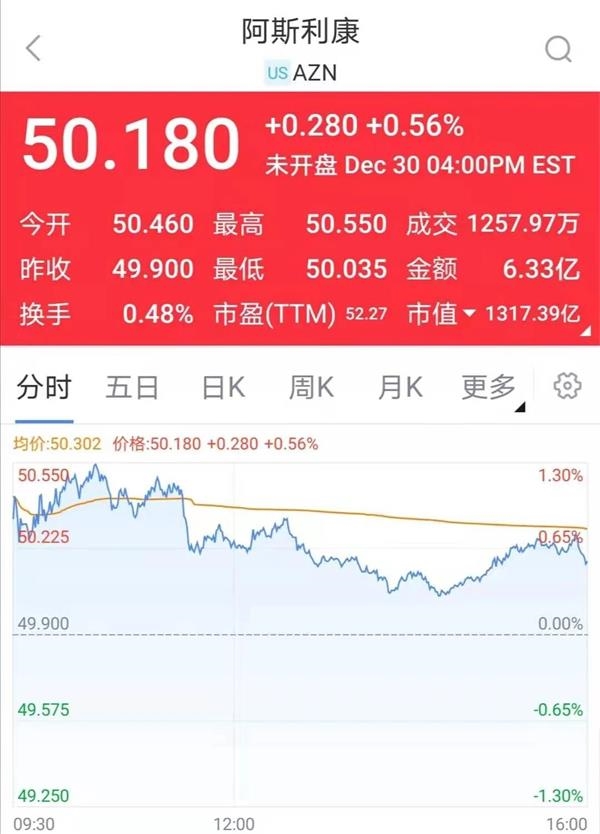
然而值得注意的是,这款备受争议的疫苗并未获得欧盟批准。欧盟药品管理局(EMA)表示,为进一步确定该疫苗的安全性和防治能力,需更多数据才能作出审批决定。
01
阿斯利康新冠疫苗获英国紧急使用批准
据21世纪经济报道,英国药品和保健产品监管局(MHRA)已授权阿斯利康COVID-19疫苗AZD1222紧急使用,以供18岁及以上人群进行主动免疫。建议该疫苗进行两次注射,间隔为4到12周。临床试验表明,该方案可有效预防症状性COVID-19的感染,第二次给药后14天以上没有出现严重病例,也没有住院病例。
该款疫苗,由牛津大学及其衍生公司Vaccitech共同研发。其使用基于普通感冒病毒(腺病毒)的弱化版本的复制缺陷型黑猩猩病毒载体,该病毒在黑猩猩中引起感染,并包含SARS-CoV-2病毒刺突蛋白的遗传物质。接种疫苗后,会产生表面刺突蛋白,如果后来感染人体,则会激发免疫系统攻击SARS-CoV-2病毒。
阿斯利康正在与MHRA以及英国疫苗接种和免疫联合委员会一起,与英国公共卫生部和英国国家卫生局合作,在英国部署和推广该疫苗。该公司计划在2021年第一季度提供数百万剂,这是与政府达成的协议的一部分,按照协议,阿斯利康将总共为英国提供1亿剂疫苗。
英国政府表示,AZD1222疫苗将会优先分发给易感人群,下周一开始注射。
阿斯利康首席执行官Pascal Soriot表示,“对于英国数百万可以使用这种新疫苗的人们来说,今天是重要的一天。它被证明是有效的,耐受性良好,易于管理,由阿斯利康免费提供。我们要感谢阿斯利康、牛津大学、英国政府的许多同事以及成千上万的临床试验参与者。”
MHRA的审批决定基于其人类医学委员会在对试验数据进行滚动审核后的独立建议,其中包括对牛津大学领导的III期计划的中期分析。该数据于2020年12月8日发表在《柳叶刀》上。
疫苗的其他安全性和有效性数据将从仍在进行的临床试验中继续积累。阿斯利康将继续与世界各地的监管机构合作,以支持他们在健康危机期间对紧急供应或有条件的营销授权,进行持续的滚动审查。阿斯利康还正在向世界卫生组织寻求紧急用途清单,以加快让中低收入国家获得疫苗。
阿斯利康称预计在2021年,全球范围内将生产约30亿剂疫苗。该疫苗可以在正常冷藏条件下(二十八摄氏度/华氏36-46度)储运至少六个月,并可以在现有医疗机构内使用。
02
欧盟未通过
值得注意的是,这款备受争议的疫苗暂未获得欧盟批准。
据外媒12月31日最新报道,在获得本国批准后,阿斯利康(AstraZeneca)表示,该公司已经向欧盟药品管理局(EMA)申请了疫苗在当地的紧急使用权,全部疫苗临床试验数据均已提交。
而EMA回应称,该机构12月21日就已经收到了阿斯利康疫苗的三清试验数据,当前正对这些数据资料进行评估。不过他们认为,为进一步确定该疫苗的安全性和防治能力,仍需更多数据,才能作出审批决定。
也就是说,欧盟药品管理局认为,阿斯利康疫苗当前的试验数据并不足以证明其安全性和有效性。因此阿斯利康很可能需要重启试验,以提供更多数据来通过欧盟审批。
据外媒引述参与英国疫苗审批的官员Munir Pirmohamed指,阿斯利康疫苗在两剂注射间隔三个月的情况下,有效率可以高达80%,但目前没有足够证据支持注射一剂的接种方式。另一位参与疫苗审批的英国医生Wei Shen Lim亦透露,在接种第一剂疫苗21日后及在接种第二剂前,有效率约为70%。
03
数据存“重大漏洞”?
事实上,阿斯利康疫苗披露三期试验数据后,就饱受科学家的质疑。据央视新闻12月10日报道,该疫苗11月23日公布的70.4%有效率,是综合两组试验数据得到的。在其8895人的2剂方案试验中,疫苗有效率仅62%;而在2741人是1.5剂方案中,有效率则高达90%。
一些专家怀疑阿斯利康疫苗数据存在“重大漏洞”。他们认为,有效率为90%这一组试验,样本量较少,很难说明这一有效率到底是真实结果,还是偶然所致的偏差结果。此外,部分关键数据缺乏透明度。
12月8日,阿斯利康在《柳叶刀》公布其新冠疫苗的III期临床试验的中期分析结果,数据显示收受试者先后接受两种标准剂量疫苗后,有效性为62%,明显低于辉瑞/ BioNTech和Moderna的mRNA疫苗的有效性;而接种一剂低剂量后再接种标准剂量疫苗后,有效性高达90%,表现出了明显的保护效力。
据了解,阿斯利康透露在III期临床试验前期试验中,部分受试者在接种疫苗时出现了失误,3000名受试者第一剂疫苗只接种了一半剂量,也正是这3000名受试者的试验有效性为90%。
当时有媒体将其称之为 “美丽的错误”,不过结果虽然美丽,但是在人体临床试验中出现错误也遭到不少诟病。毕竟这两种给药方案试验结果不同,因此越来越多的人对该疫苗的临床试验数据存疑。
此外,该疫苗受试者年龄不超过55岁,一般来说,老年人易感新冠病毒,免疫反应更慢。这一研究结果让人怀疑疫苗是否经得起进一步的检测。
目前,AZD1222正在美国进行一项40000人的临床试验。阿斯利康首席执行官Pascal Soriot表示,要获得美国FDA的审批,需要在美国进行的临床数据。牛津大学疫苗学教授Sarah Gilbert也表示,“临床试验的结果取决于试验的进展,研究人员也不确定美国何时能够获得临床数据。”
除此之外,AZD1222的标准剂量方案不够好。在英国的临床试验中,接受两种标准剂量的患者的有效性是62%,但是置信区间下限是28%,低于FDA的30%的标准。这也是FDA不会在近期批准AZD1222的原因之一。
值得一提的是,今年9月初,一名英国志愿者接种AZD1222后出现不良反应,阿斯利康叫停了全球的临床试验,今年10月份,FDA再审核了这款疫苗的数据后,认为是安全的,并授权恢复了这项试验。
尽管AZD1222已在英国获批,但要过欧盟这一关比较难。对此,阿斯利康曾暗示,可能会重启试验,对疫苗展开一轮额外的三期试验,验证1.5剂方案的最终有效率。为获得欧盟的审批,该英国企业重启试验的概率非常大。
据统计,由于早期被看好,阿斯利康已获得超20亿剂的疫苗预购订单。其是第一家与欧盟签订合同的公司,合同总剂量是3亿剂,可以选择增加1亿剂。
截至目前,获EMA批准的新冠疫苗只有辉瑞/BioNTech。据EMA官网消息,Moderna的疫苗将于2021年1月6日举行会议以评估疫苗的有效性,必要情况下,1月12日会再次举行会议。












